先の記事にて、紫外線蛍光写真のおさらい的なことを少し見ました。もし気になられるようでしたら、先にそちらを読んでいただけると幸いです。
この記事は、「そもそも紫外線は人間の目に見えないのに、それを作品に照射して、何かが見えるって変じゃない…?」ということに端を発しています。人間が視覚的に認識できるのは可視光線領域であって、紫外線というのは可視光線の「紫」の領域の「外」にあることから、人間には認識できない領域だからです。
ただ、これは勘違いというもので(^^;)。紫外線を作品に照射することで見ているのは、紫外線の反射ではないんだ、ということが大事だったりします。では、文化財保存修復の専門に限らず、紫外線を照射して「何かを見る」ということは、何をしているのかというと、「紫外線を照射された物質が【蛍光】している様子」を観察しているわけです。
というわけで【蛍光】って何なのよ、というお話をします。紫外線蛍光に限らず、【蛍光】という調査が出てくるときの基本的構造がこういうことだよ理解してもらえるとよいのではないかなと思います。
【蛍光】の原理を理解するのは、原子レベルの知識が必要
なんだかもう、上の見出しだけでこの記事は読まれていないような気がしています(笑)。原子、つまり化学の話?!と思うと、いや~な気持ちになるの、わかります(苦笑)。
とはいえ現代における文化財保存修復の分野は、化学の知識は必須ですし、「仕事で必要!」と思うとおおよそ大概の人は100点とはいえずとも最低限必要なことは理解するものですので…(と言い訳をしてみる。汗)。
というわけで説明させていただくと、地球上の物体にせよ、液体にせよ、気体にせよ、原子というものから成り立っています。さらに、この原子というものを細かく見てみると、原子核と電子というものからなることがわかります。
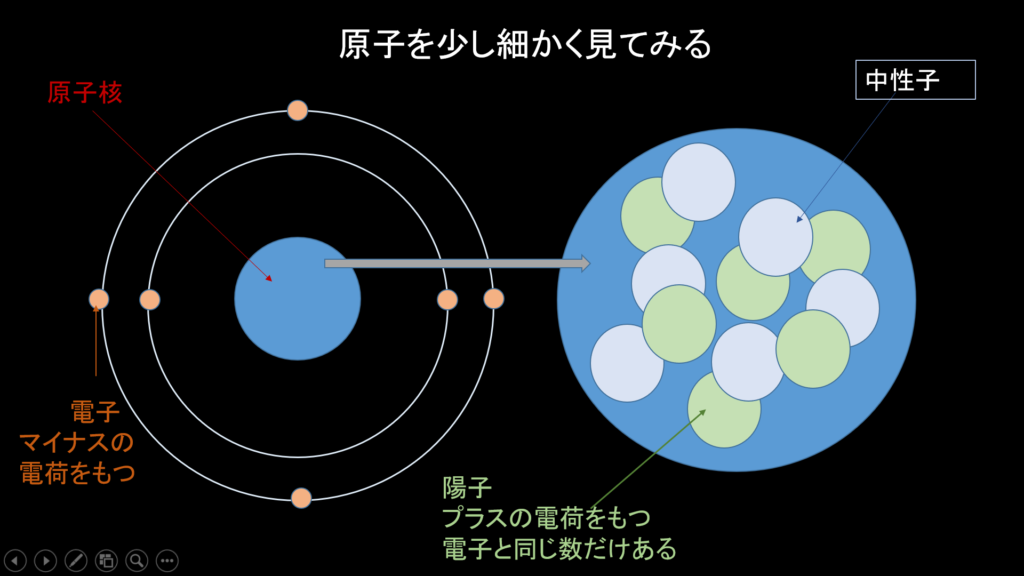
さらに原子核の中を見ると、陽子(「ようこ」じゃなくて「ようし」ね)と中性子というものが存在します。中性子というのは荷電をもたないニュートラルな子(いわゆる、電気や磁石のようなプラスマイナスの力を持たない、ということ)ですが、陽子はプラスの荷電を持ちます。
ここで「おや」と気づいてほしいのは、原子核の外側にいるのはマイナスの荷電をもつ電子ですね。さらにこの電子の数は常に原子核の中にある陽子の数と同じという法則があります。
プラスとマイナスの力、というと「磁石」を考えていただけるとわかりよいかと思うのですが、プラスとマイナスというのは引き合いますよね。こういうプラスの陽子とマイナスの電子が同数あることで、プラスとマイナスの荷電は互いに引っ張り合って、電子は中央の陽子に引っ張られながら、原子核の周りをくるくる回るというそういう性質を持つらしいのです。
ところで、上記は電子は原子核の周りをくるくる回ると書きましたが、闇雲に、お約束なしに回っているわけではありません。というのも原子核の周りには電子殻という、電子がまわるべき軌道が複数層あるためです。…すでに分からへん…というお気持ちわかります。化学が全く理解できなかった頃、「なんやねん、電子殻って!見えないものの話はやめて~!」と思ったこと、ブログ主にはありますので。でも、頑張って読んでみてください(滝汗)。
これ、原則として、原子それぞれが保有する電子の数が決まっているということが前提ね。化学の勉強をすると、にっくき「元素の周期表」というのが出てきますが、水素を左上にして、右に進み、そして下の段…と進むあれは、ひとつひとつ陽子の数が違うから、陽子の数を「原子番号」として、その小さい順に並べているわけね。もっというと、陽子の数と電子の数は同数よ。
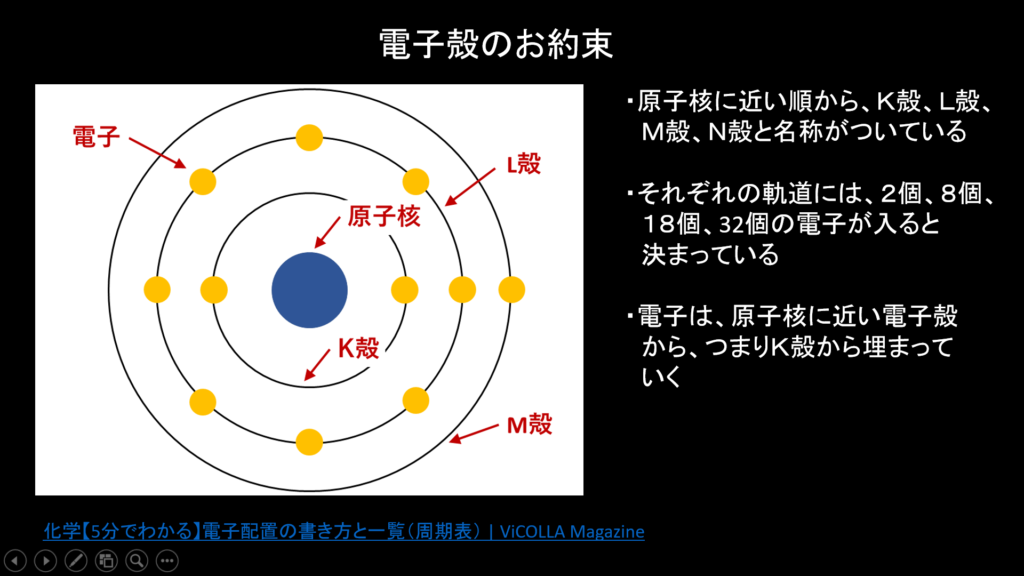
なので、例えば水素(H)の場合は電子が1個、酸素(O)の場合は電子を6個持っているのですが、やみくもにそれぞれの電子が原子の周囲にあるわけではないということを先の図は表しています。
というのもどうやら原子核の周りには電子殻という、電子がまわるべき軌道が複数層あるためなんですね。つまり、原子によって決められた半径で、電子は原子殻の周りをまわっているということです。ちなみにこの電子が配置されるいくつかの軌道には、内側から、K殻、L殻、M殻、N殻と名称がついています。
そしてさらに面倒なことに、なんとこの軌道には、それぞれ2個、8個、18個、32個と、電子が入れる数が決まっているのです。これはどの原子でも同じね。
で、さらに電子殻のどこから電子が入っていくかというと、電子殻の中でも原子核に近い軌道から電子が埋まっていくというのがお約束らしいです。
ですので、例えば原子番号6(陽子の数が6個)のO(酸素)の場合、電子の数が6個。なので、まず原子核に最も近いK殻の2席が埋まります。そうすると残りの電子の数は4個なので、次に原子核に近いL殻(8個場所がある)に残り4個が場所を得る、という形になります。
ブログ主自身、高校時代は化学が苦手で、この椅子取りゲームみたいな話自体、「目に見える話じゃないのに、何言っているの?」みたいなところがあったので、この話すら「は?」という方の気持ちは結構いたいほどにわかります(^^;)。実生活でこんなミクロな話、目に見えないですからね。とはいえ、まずここがきちんと理解できると、化学嫌いの過去を持つ人間からしても、一つ、頭がすっきりいって、次のステップまで大分理解しやすくなるという実感がありますので、高校化学の市販の参考書とかで十分ですので、一度この部分は「わかってるよ!」って程度に理解ができるといいなぁと思います。
本日のまとめ的なもの
文化財保存修復のブログのはずが、なんでこんな基礎化学を…と思われそうですけどね。大学の場合、日本でも外国でも絶対1年次に出てくるのが基礎化学です(さらにいうと、ヨーロッパの場合は、その後実技ではない専門授業の半分程度は物理化学関係という地獄になります。苦笑)。
なぜかというと、絵具の物性を理解するなり、修復素材を理解するなり、何をするにも化学的な見地というのは現代においては避けることが絶対できないからです。「なぜこの素材からできている作品に対し、その素材をその濃度で使うのか」というようなことを、理由として分かっていないと、作品を損傷させない処置、将来的に可逆できる処置というのは難しいんですね。
だからこそですが、もともと化学嫌いのブログ主ですが、ヨーロッパ在住時は本当に必死で化学を勉強しましたし、その分理解できた喜びがあって。でも、仕事をしていると、その都度都度新しい疑問や、新規の素材とかがでてきたりして、「理論上はそうだけど…」とか、いろんなことに悩んだりもしますし、「これ以上学ばなくても大丈夫」ということはなくて。
で、そういう時にいつも立ち戻るのは基本といいますか…。自分自身、こういうブログを書きながら、復習したり、どうなんだろうなぁと色々考えたりします。
なので、「今、完璧じゃなきゃ」である必要はなくて、グラデーションのように、少しずつ、昨日よりも今日、今日より明日と学んでいけたらいいなぁと思うのです。
というわけで本日はここまで。最後まで読んで下さり、ありがとうございます。








コメント